Biofilm
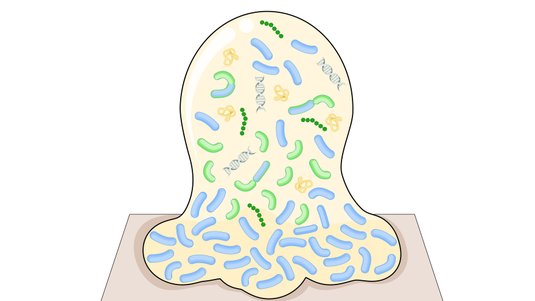
Ein Biofilm ist eine komplexe Ansammlung von Mikroorganismen (aerobe und anaerobe Bakterien sowie Pilze), die sich auf Wundoberflächen ansiedeln und durch eine selbstproduzierte Schleimschicht geschützt werden. Bis zu 78 % der chronischen Wunden sind mit einem Biofilm belastet.
Die Entfernung des Biofilms ist entscheidend für die Wundheilung. Dafür kommen spezielle Verfahren, zum Beispiel ein chirurgisches Débridement, zum Einsatz.
- Video: Antimikrobielle Wundversorgung
- Download: Schnellratgeber infizierte Wunden
- Video: Störenfriede auf der Wunde - Nekrose, Biofilm und Fibrin
Was ist ein Biofilm?
Ein Biofilm ist eine Lebensgemeinschaft unterschiedlicher Mikroorganismen, hauptsächlich Bakterien, die an der Wundoberfläche haften und von einer selbst produzierten Schleimschicht, der sogenannten Matrix, umgeben sind. Die Matrix besteht aus Matrixsubstanz, auch extrazelluläre polymere Substanz (EPS) genannt. Die Zusammensetzung der EPS variiert zwischen den verschiedenen Mikroorganismen. In der Regel finden sich Schichten von Polysacchariden, Proteinen, Lipiden und Bakterien-DNA. Die Matrix verankert den Biofilm fest an einer Oberfläche.
Im Biofilm kommunizieren die Bakterien untereinander über Botenstoffe und koordinieren so ihr Verhalten, Stoffaustausch und Nährstoffaufnahme auf engem Raum. Durch die räumliche Nähe zueinander können die Bakterien zudem genetisches Material und damit auch Resistenzgene austauschen. Diese effektive Zusammenarbeit verschafft den Mikroben eines Biofilms einen bedeutsamen Vorteil gegenüber einzelnen Bakterien. Erreger in einem Biofilm sind extrem widerstandsfähig gegenüber Umweltfaktoren wie Austrocknung, Antibiotika, Antiseptika oder dem Immunsystem des Menschen. Dadurch verhindern Biofilme die Wundheilung und gelten als ein hartnäckiges Problem in der Wundversorgung.
Welche Rolle spielen Biofilme in der Wundheilung?
Biofilme stellen eine wesentliche Ursache für Wundheilungsstörungen und eine verzögerte Wundheilung dar. Sie können eine anhaltende Entzündungsreaktion auslösen, die den natürlichen Heilungsprozess behindert. Die Immunzellen des Körpers versuchen ständig die Erreger zu bekämpfen, was zu einer chronischen Entzündung und Gewebeschädigung führen kann.
Zudem sind Biofilme im Vergleich zu freien Erregern unempfindlicher gegenüber Behandlungen mit Antiseptika oder Antibiotika und dem körpereigenen Immunsystem. Die Unempfindlichkeit des Biofilms beruht auf verschiedenen Mechanismen. Zum einen schützt die Biofilm-Matrix die Mikroorganismen vor Antiseptika, Antibiotika und Immunzellen. Des Weiteren besitzen die Mikroorganismen in Biofilmen teilweise einen niedrigeren Stoffwechsel. Dadurch sind mit einem Biofilm besiedelte Wunden schwer zu behandeln, weil viele Antibiotika nur gegen stoffwechselaktive Bakterien eingesetzt werden können.
Woran erkennt man einen Biofilm in einer Wunde?
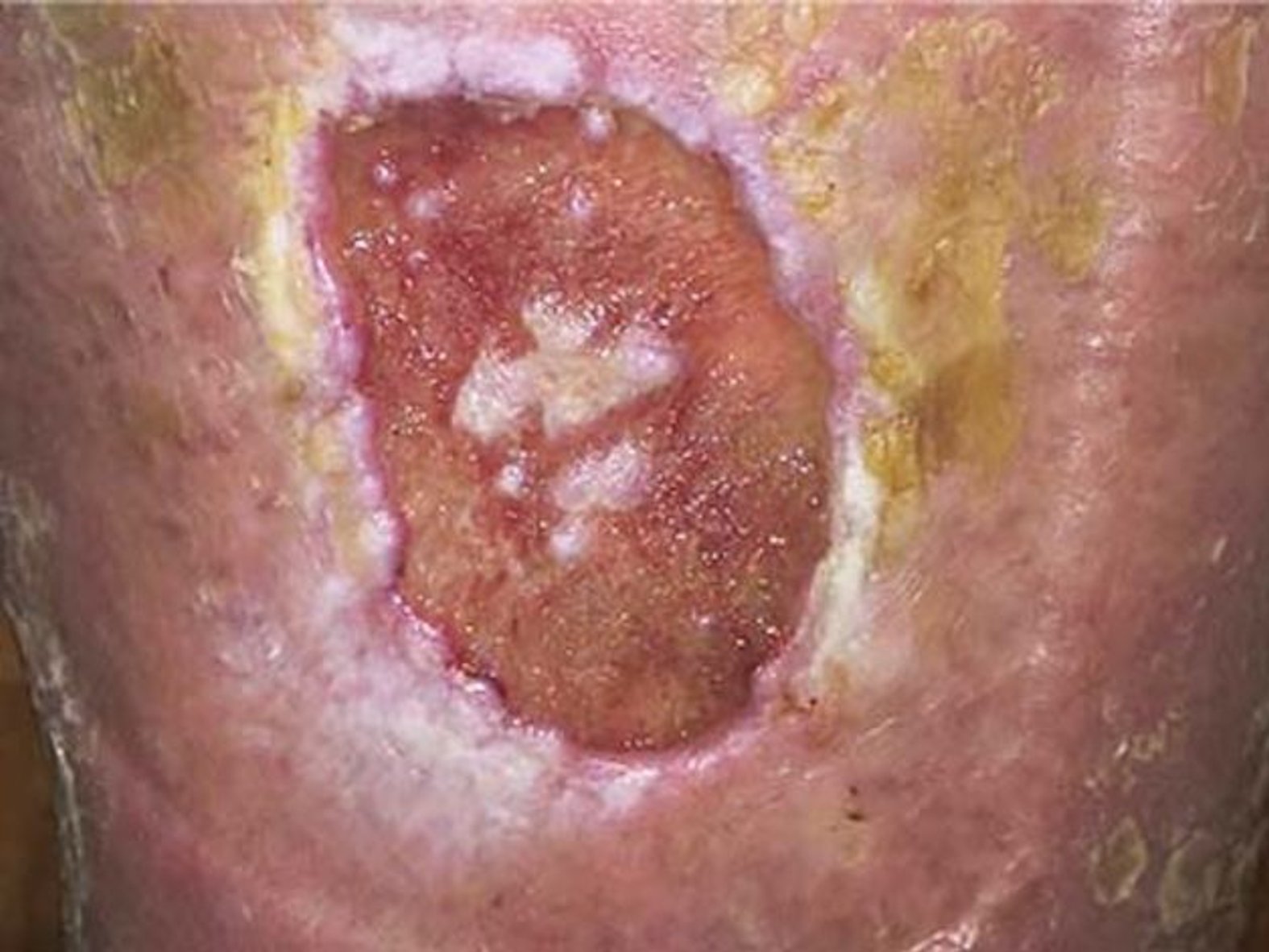
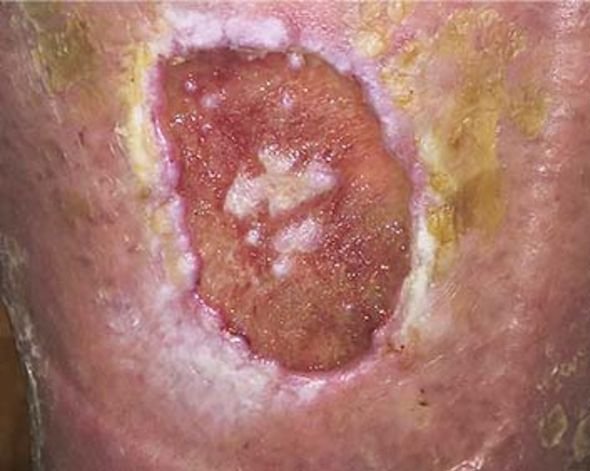
Unter dem Mikroskop ist ein Biofilm mit seinen mikrobiellen Ansiedlungen gut zu identifizieren. Um einen Biofilm mit bloßem Auge zu erkennen, muss er über einen längeren Zeitraum wachsen. In diesem Fall erscheint der Wundgrund gelartig glänzend belegt. Eine Stagnation der Wundheilung trotz beherrschter Grunderkrankung kann ein Hinweis auf einen Biofilm sein.
Was ist die sicherste Methode, um einen Biofilm zu reduzieren?
Grundsätzlich beruht die Behandlung auf der Reduzierung des Biofilms, der Verhinderung der Wiederherstellung (Rekonstitution) und der Verhinderung der Rekontamination durch einen geeigneten Schutzverband.
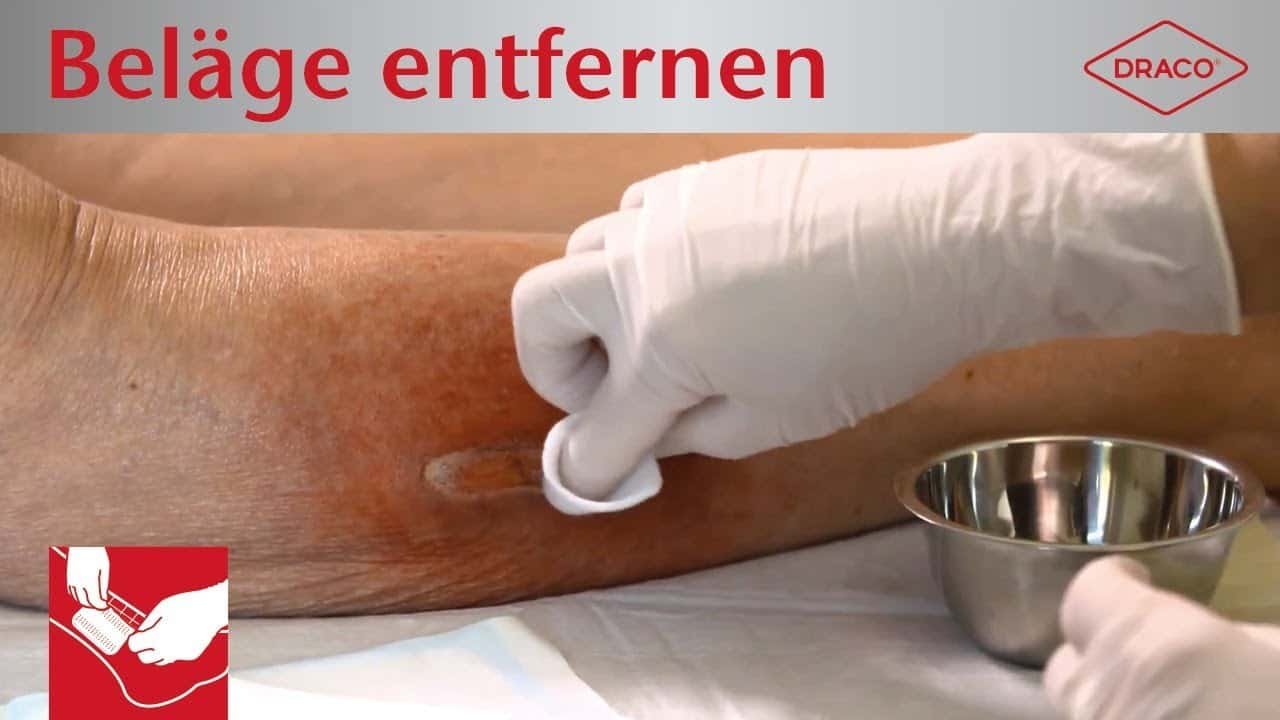
Der Biofilm sollte mechanisch entfernt werden. Die Erfahrung zeigt, dass ein mechanisches Débridement oft nicht ausreicht, um den Biofilm aufzubrechen. Dann können ein scharfes / chirurgisches Débridement oder die ultraschall assistierte Wundreinigung (UAW) hilfreich sein. Eine regelmäßige, möglichst tägliche Wundreinigung und die dazugehörige leitliniengerechte Wundversorgung gelten als Grundvoraussetzung für eine dauerhafte Reduktion des Biofilms.
Lokale Antibiotika werden aktuell nicht zur Behandlung eines Biofilms empfohlen.
Wie unterscheidet sich der Biofilm von anderen Wundbelägen?
Bei einem Biofilm handelt es sich um eine körperfremde Substanz, die von Mikroorganismen hergestellt wird. Im Gegensatz dazu entstehen andere Wundbeläge, wie z. B. Fibrin, im Rahmen von körpereigenen Prozessen. Einen Biofilm zu erkennen, ist mit bloßem Auge oft schwierig. Bei einem Biofilm entsteht durch die besondere Matrix eine gelartige Masse, die auf der Wunde glänzend erscheint. In die Matrix eingebettete Mikroorganismen sind gegen das menschliche Immunsystem und antimikrobielle Substanzen geschützt.
Ein Biofilm stellt deshalb eine besonders hartnäckige und komplexe Form von Wundbelag dar, die eine spezielle und oft intensivere Behandlung im Vergleich zu anderen Wundbelägen wie Fibrinbeläge oder Nekrosen erfordert. Fibrinbeläge erscheinen in der Regel eher gelblich-trübe. Ein nekrotischer Wundbelag besteht aus totem, abgestorbenem Gewebe. Dieses kann gelb, braun oder schwarz aussehen.
Welche Risikofaktoren begünstigen die Bildung eines Biofilms auf chronischen Wunden?
Der Allgemeinzustand des Patienten oder der Patientin spielt vor allem bei chronischen Wunden eine große Rolle. Bei Menschen mit einem geschwächten Immunsystem, unausgewogener Ernährung, Durchblutungsstörungen im Gewebe oder auch nekrotischen Gewebeanteilen kann das Wachstum eines Biofilms begünstigt sein.
Wie bilden sich Biofilme?
Grundsätzlich können Biofilme aus Gemeinschaften unterschiedlicher Bakterien, Viren oder Pilzen bestehen. Zu den medizinisch bedeutsamen Mikroorganismen, die Biofilme bilden, gehören unter anderem Staphylokokken, Streptokokken und Pseudomonaden. Die Bildung eines Biofilms erfolgt in mehreren Phasen:
Phase 1: Reversible Oberflächenanheftung
Einzelne Mikroorganismen heften sich an eine Oberfläche an. Dies geschieht durch schwache physikalische Wechselwirkungen (Grenzflächenhaftung) und/oder durch spezifische Adhäsionsmoleküle. Eine Grenzfläche ist die Fläche zwischen zwei Phasen, z.B. die Fläche zwischen einer Flüssigkeit und einem Feststoff. Der Wundgrund ist ein Beispiel für eine Grenzfläche, an der sich Mikroorganismen zunächst lose anheften, um später einen Biofilm zu entwickeln. Die erste Anlagerung ist umkehrbar (reversibel).
Phase 2: Permanente Oberflächenanheftung
Die anfänglich anhaftenden Zellen beginnen sich zu teilen und siedeln in kurzer Zeit immer fester an der Oberfläche. Über chemische Signale locken die bereits im Biofilm angesiedelten Erreger neue Erreger an.
Phase 3: Schleimige schützende Matrix/Biofilm
Sobald die Mikroorganismen fest verankert sind, beginnen sie mit der Absonderung der Matrixsubstanz. Die schützende Matrix entsteht.
Wie schnell bilden sich Biofilme?
Laboruntersuchungen zeigen, dass z. B. Staphylococcus, Streptococcus, Pseudomonas und Escherichia coli sich innerhalb von wenigen Minuten an eine Oberfläche anheften.
Nach 2 bis 4 Stunden ist eine starke Anheftung vorhanden. Innerhalb von 2 bis 4 Tagen wachsen die Mikroorganismen – je nach Wachstumsbedingungen – zu einem vollausgereiften Biofilm heran.
Sie erholen sich rasch von mechanischer Zerstörung wie dem Wunddebridement. Innerhalb von 24 Stunden können sie wieder einen reifen Biofilm erzeugen.
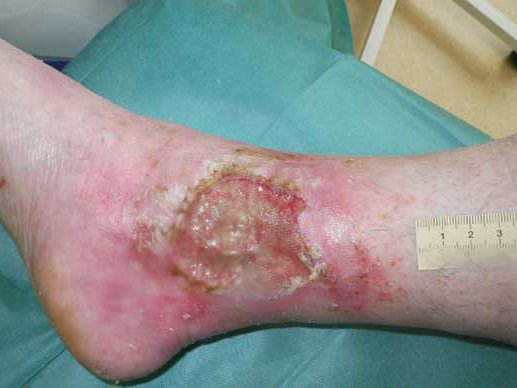
In diesem Fallbeispiel können Sie nachlesen, wie eine stark mit Biofilm belegte Wunde geheilt werden konnte.
Fallbeispiel lesenWie unterscheidet sich der Biofilm vom Wundbelag?
Beim Biofilm entsteht durch die besondere Matrix eine gelartige Masse, die auf der Wunde glänzend erscheint. Wundbeläge sehen in der Regel eher gelblich-trübe aus. Bekannt ist, dass ein Fibrinbelag in einer chronischen Wunde ständig Entzündungsprozessen ausgesetzt ist. So ist es also möglich, dass sich der Biofilm auf einen bereits in der Wunde vorhandenen Fibrinbelag draufsetzt. Demnach kann ein Wundbelag ein Hinweis für das Vorhandensein eines Biofilms sein.
Ist die Bildung des Biofilms abhängig vom Allgemeinzustand des Patienten?
Der Allgemeinzustand des Patienten spielt vor allem bei chronischen Wunden in der Regel eine große Rolle. Bei Menschen mit einem geschwächten Immunsystem, unausgewogener Ernährung, Durchblutungsstörungen im Gewebe oder auch nekrotischen Gewebeanteilen kann das Wachstum eines Biofilms begünstig sein.
Videos: Entfernung von Biofilm und anderen Belägen
Bei Start des Videos werden Informationen an YouTube/Google übermittelt. Mehr hierzu unter: Google Datenschutzerklärung.
Bei Start des Videos werden Informationen an YouTube/Google übermittelt. Mehr hierzu unter: Google Datenschutzerklärung.
Wo sind Biofilme im menschlichen Körper zu finden?
Biofilme entwickeln sich nicht nur auf der Wundoberfläche von chronischen Wunden. Zahnbelag (Plaque) ist ein typisches Beispiel für einen Biofilm. Er besteht aus Bakterien, die sich an die Zahnoberflächen anheften und in einer schleimigen Matrix wachsen. Schon innerhalb eines Tages nach der letzten Zahnpflege ist Plaque auf der Zahnoberfläche sichtbar und mit der Zunge spürbar. Biofilme in Zahnfleischtaschen gelten als Hauptverursacher von Zahnfleischentzündung (Gingivitis) und Parodontitis.
Auch auf Fremdmaterialien, die gezielt in den Körper eingebracht werden, siedeln sich Biofilm-bildende Keime mitunter an. Biofilme auf Hüftprothesen, Implantaten, Blasenkathetern, Herzschrittmachern, Dialyse-Shunts oder künstlichen Herzklappen stellen ein zunehmendes Problem dar.
Literatur
Patienten mit chronischen Wunden sollten darüber informiert werden, dass Biofilme auf einer Wunde nur durch folgende kontinuierliche Maßnahmen zu entfernen sind:
- Wundreinigung,
- Debridement der Wunde,
- leitliniengerechte Wundversorgung
- Einsetzen von antimikrobiellen Wirkstoffen
Werden diese Maßnahmen nicht täglich durchgeführt, kann es zu einer deutlichen Wundheilungsverzögerung kommen.