Nekrotisierende Fasziitis
Eine nekrotisierende Fasziitis ist eine seltene, aber gefährliche bakterielle Weichteilinfektion, bei der das infizierte Gewebe plötzlich und sehr rasch (foudroyant) entlang der betroffenen Faszien abstirbt. Weil dieses abgestorbene Gewebe als Nekrose bezeichnet wird, heißt die Erkrankung nekrotisierende Fasziitis.
Hauptanzeichen einer nekrotisierenden Fasziitis sind ungewöhnlich starke Schmerzen, Fieber und ein starkes Krankheitsgefühl. Die Infektion muss nicht zwingend von außen auf der Haut sichtbar sein.
Behandlung und Therapie
Eine nekrotisierende Fasziitis ist immer ein Notfall, der ohne eine frühzeitige Therapie eine schlechte Prognose aufweist und in etwa 30 Prozent der Fälle tödlich enden kann. Ältere Personen und Menschen mit Begleiterkrankungen haben ein noch höheres Sterblichkeitsrisiko.
Die Therapie der nekrotisierenden Fasziitis muss unverzüglich und chirurgisch erfolgen, sobald der Verdacht besteht. Wichtig ist, dass die chirurgische Abtragung gründlich erfolgt und nicht durch diagnostische Maßnahmen verzögert wird. Die Überlebenschance bei nekrotisierender Fasziitis sinkt weiter bei Verzögerungen der Behandlung und einer unzureichenden Abtragung.
Chirurgische Therapie
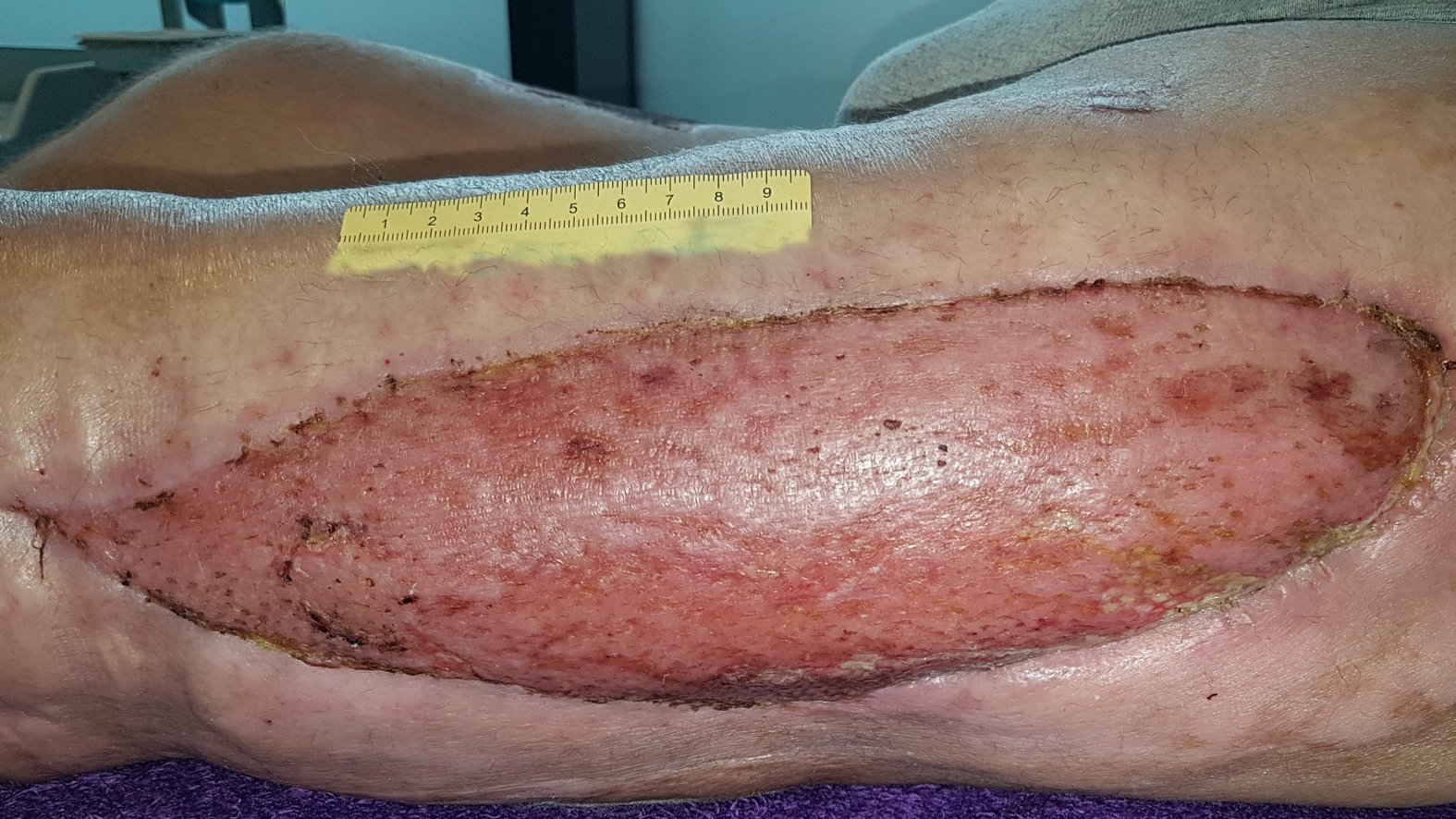
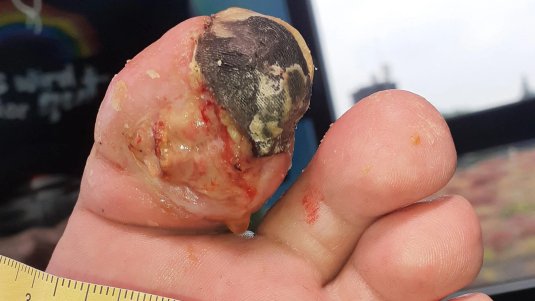
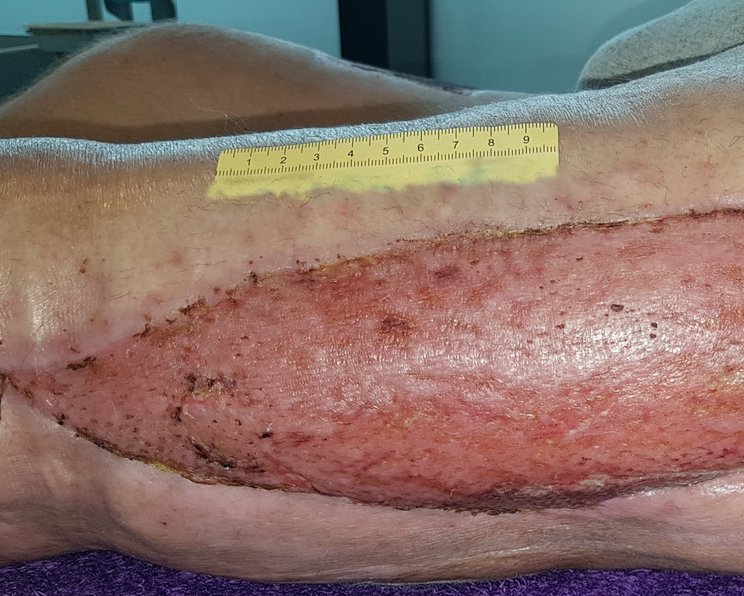
Die chirurgische Behandlung besteht aus der Offenlegung sowie gründlichen Untersuchung des betroffenen Gewebes und radikalem Débridement. Dazu muss das nekrotische Gewebe großzügig bis in das vitale Gewebe hinein entfernt werden. Wichtig ist, dass nicht nur die Nekrosen vollständig entfernt werden. Außerdem müssen die bakteriellen Giftstoffe (Toxine), die die Nekrose auslösen, beseitigt werden. In den folgenden Tagen kann ein regelmäßiges chirurgisches Redébridement notwendig sein, das nach individueller Situation etwa alle 1-2 Tage erfolgt.
Die Wunde wird erst verschlossen, wenn eine Verbesserung des Allgemeinzustands eingetreten und Granulation erkennbar ist. In unkomplizierten Fällen kann der sekundäre Wundverschluss nach ca. sieben bis zehn Tagen durchgeführt werden. Häufig durchgeführte plastische Verfahren zur Deckung sind Sekundärnaht, Meshgraft oder Schwenklappen.
Im Spätstadium oder bei deutlicher Muskelbeteiligung kann die Amputation von Gliedmaßen notwendig sein, um das Leben des betroffenen Menschen zu retten.
Antibiotika
Eine intravenöse Verabreichung von Antibiotika muss unmittelbar nach der Verdachtsdiagnose auf nekrotisierende Fasziitis eingeleitet werden.
Da zu diesem Zeitpunkt noch keine Ergebnisse aus bakteriologischen Untersuchungen vorliegen, werden mehrere Wirkstoffe kombiniert. Während der Operation werden Gewebekulturen angelegt und untersucht. Sobald der Erreger bekannt ist, muss die Wahl der Antibiotika entsprechend angepasst werden.
- Sekundärnaht: Chirurgisches Zusammenfügen der Wundränder mittels Naht in einer späten Wundheilungsphase (ab Granulationsphase).
Transplantation von Eigenhaut (autologe Hauttransplantation):
- Meshgraft: Spalthaut von geeigneter Körperstelle (z. B. Oberschenkel) des Betroffenen, die netzartig eingeschnitten wurde, um die Fläche des Transplantats zu vergrößern. Dieses Netz wird auf den zu deckenden Defekt transplantiert.
- Schwenklappen: Gewebe aus unmittelbarer Nähe der Wunde wird zur Defektdeckung auf die Wunde verschoben (Verschiebeplastik).
Wundversorgung
Nach der chirurgischen Behandlung der nekrotisierenden Fasziitis ist eine angepasste Wundversorgung notwendig.
Zunächst erfolgt ein vorübergehender (temporärer) Wundverschluss, da sämtliche Nekrosen und bakterielle Toxine sicher aus dem Gewebe entfernt sein müssen. Für einen temporären Wundverschluss eignen sich Hautersatz-Produkte sowie die Vakuumversiegelungstherapie.
Nach dem sekundären Wundverschluss sollte die Wunde idealfeucht und phasengerecht versorgt werden. Hat eine Spalthautentnahme oder Verschiebeplastik stattgefunden, muss auch diese Wunde angepasst versorgt werden.
Weitere Maßnahmen
- Zufuhr großer Flüssigkeitsmengen: zusammen mit der Antibiose muss die intravenöse Zufuhr von Flüssigkeit erfolgen. Auch nach dem operativen Eingriff soll weiterhin Flüssigkeit intravenös zugeführt werden
- Hyperbare Sauerstofftherapie: unterstützende Therapie, bei der über einen bestimmten Zeitraum unter Überdruck reiner Sauerstoff eingeatmet wird
- Immunglobuline: intravenöse Verabreichung, wenn zusätzlich zur nekrotisierenden Fasziitis ein Toxisches-Schock-Syndrom (TSS) auftritt, was durch Toxine von Staphylokokken oder Streptokokken verursacht wird
- Anlage eines künstlichen Darmausgangs (Ileo- oder Kolostoma): kann bei Menschen mit Fournierschen Gangrän notwendig sein, damit die Wunde und die Umgebungshaut nicht durch Stuhl belastet bzw. verkeimt wird. Die Fourniersche Gangrän ist eine nekrotisierende Fasziitis in der Leisten- oder Genitalregion. Wenn die Wunde verheilt ist, kann der Darmausgang wieder an die ursprüngliche Position zurückverlagert werden.
Symptome
Charakteristisch für eine nekrotisierende Fasziitis sind plötzlich auftretende sehr starke Schmerzen. Hinzu kommen ein heftiges Krankheitsgefühl und hohes Fieber. Im weiteren Verlauf können Verwirrtheitszustände bis zum Bewusstseinsverlust auftreten.
Die im Vergleich zum äußeren klinischen Befund unverhältnismäßig starken Schmerzen sind ein erster Hinweis auf eine nekrotisierende Fasziitis. Dabei kann jede Stelle des Körpers betroffen sein. Bei fortschreitendem Gewebeabsterben nehmen die Schmerzen ab, da dann auch die Nerven absterben und das Gefühl in dem Bereich komplett verloren geht.
Was sind die sichtbaren Symptome einer nekrotisierenden Fasziitis?
Auf der Haut erkennbare Symptome sind variabel. Sie reichen von unauffällig aussehender Haut bis zur Schwarzfärbung aufgrund des bereits abgestorbenen Gewebes:
- gerötete und überwärmte Haut
- violette Verfärbung, evtl. zusammen mit großen flüssigkeitsgefüllten Blasen
- Bläschen auf der Haut und knisternde Hautbereiche bei Infektion mit gasproduzierenden Bakterien wie Clostridien
- schwarze Hautbereiche, wenn das Gewebe abgestorben ist
Diagnose
Die Diagnose einer nekrotisierenden Fasziitis basiert auf der ärztlichen Untersuchung, Röntgenaufnahmen und Laboruntersuchungen von Blut- und Wundkulturen.
Die Diagnose muss schnell gestellt werden und erfolgt beinahe gleichzeitig mit der chirurgischen Behandlung. Bei einer chirurgischen Exploration sind subkutane Nekrosen mit Faszienbeteiligung und Unterminierung der umliegenden Gewebe feststellbar. Die Muskulatur ist in späteren Stadien ebenfalls betroffen.
Im Röntgenbild werden evtl. Gasansammlungen im Weichteilgewebe sichtbar, die Blutkulturen sind positiv und der Allgemeinzustand verschlechtert sich rapide.
Sie wollen zusammen mit praxiserfahrenen Moderatorinnen und wunderfahrenen Kolleginnen tiefer in konkrete Fallbeispiele einsteigen? Dann besuchen Sie unsere neue Präsenzfortbildung und bringen Sie Ihr Wissen ein.
Jetzt anmelden!Inzidenz und Ursache
Die nekrotisierende Fasziitis ist in unterschiedlichen Regionen der Erde mit 0,3 bis 5 Fällen auf 100.000 Einwohner jährlich eine seltene Erkrankung. Darüber liegt lediglich Thailand, wo 15,5 jährliche Fälle auf 100.000 Einwohner beschrieben wurden.
Die Erkrankung wird durch Bakterien verursacht, die durch kleinste Verletzungen in das Gewebe eindringen. In einigen Fällen sind jedoch keine Eintrittspforten bzw. Verletzungen erkennbar. Im Gegensatz zu den meisten anderen infizierten Wunden muss die rasant fortschreitende Infektion nicht von außen sichtbar sein.
Bei der nekrotisierenden Fasziitis sondern die eingedrungenen Bakterien Toxine ab, die kleine Blutgefäße im Gewebe verschließen und zum Absterben des Gewebes führen. Die mit dem Blut transportierte Komponenten des Immunsystems, wie z. B. Antikörper, erreichen durch die verstopften Gefäße den Ort des Infektionsgeschehens nicht. Dadurch können sich die Erreger ungehindert und rasant verbreiten. Dieses rasante Absterben von Gewebe brachte der nekrotisierenden Fasziitis auch den Namen „fleischfressende Bakterien“ ein, obwohl das Gewebe im eigentlichen Sinne nicht gefressen wird.
Subtypen und Erreger
Abhängig vom verursachenden Keim wird die nekrotisierende Fasziitis in drei Subtypen unterteilt.
Typ I
Typ I betrifft meist den Rumpf und den Bereich zwischen After und den äußeren Geschlechtsorganen (Fourniersche Gangrän). Bei Menschen mit Diabetes beginnt die Infektion häufig am Fuß und breitet sich schnell in die Beine aus.
Die nekrotisierende Fasziitis vom Typ I ist eine polymikrobielle Infektion. D. h., die Infektion wird von mehreren Bakterienspezies verursacht, die durch Ulzerationen, Infektionen oder kleine Verletzungen in das Gewebe gelangen. Dazu gehören meist A-Streptokokken (z. B. Streptococcus pyogenes) sowie weitere aerobe und anaerobe Bakterien (Staphylokokken, Bacteroides fragilis, Prevotella melaninogenica, Enterobacteriaceae und Pseudomonaden).
Die Bakterien mit anaerobem Stoffwechsel produzieren unlösliche Gase, die sich im Gewebe ansammeln und sich durch Knistern bei Berührung und im Röntgenbild darstellen lassen. Dadurch ähnelt eine nekrotisierende Fasziitis vom Typ I dem Gasbrand, der auch als Gasgangrän bekannt und ebenfalls sehr gefährlich ist. Im Gegensatz zur nekrotisierenden Fasziitis vom Typ I ist der Gasbrand jedoch eine monomikrobielle Infektion, die von Clostridien verursacht wird.
Ein erhöhtes Risiko für eine nekrotisierende Fasziitis vom Typ I haben Menschen mit Diabetes sowie ältere oder immunsupprimierte Personen.
Typ II
Typ II wird von toxinproduzierenden hämolysierenden A-Streptokokken oder Staphylococcus aureus verursacht und ist eine monomikrobielle Infektion mit einer Bakterienspezies. Die Infektion verbreitet sich sehr schnell und kann zum TSS (Toxisches Schock-Syndrom) führen.
Die nekrotisierende Fasziitis vom Typ II tritt eher bei jüngeren Menschen ohne klinische Vorgeschichte auf.
Typ III
Typ III kann nach Verzehr von rohen Meeresfrüchten oder Kontakt mit kontaminiertem Wasser auftreten.
Die Infektion ist monomikrobiell und wird von Vibrionen (Vibrio-Spezies) verursacht, wobei Vibrio vulnificus der häufigste Erreger ist. Der klinische Verlauf einer Typ III Infektion ist dem einer Typ II Infektion ähnlich.
Vibrionen kommen weltweit in Süß- und Salzgewässern vor. Ein gewisses Infektionsrisiko besteht in Gewässern, in denen sich die Vibrionen stark vermehren können. Das ist bei einem Salzgehalt von 0,5-2,5 Prozent und ab einer Temperatur von über 20°C der Fall.
In den Medien wird gelegentlich von Vibrionen als „fleischfressende Bakterien“ auch in der Ostsee berichtet. Tatsächlich weist die Ostsee mit 0,8 Prozent Salzgehalt einen für Vibrionen günstigen Salzgehalt auf. Wenn dann noch sommerliche Temperaturen herrschen, können sich die Vibrionen stark vermehren. An deutschen Küsten tritt die nekrotisierende Fasziitis allerdings sehr selten auf. Zwischen 2002 und 2019 wurden dem Robert Koch Institut nur zwischen 0 bis 20 Fälle pro Jahr gemeldet.
Das Europäische Zentrum für die Prävention und Kontrolle von Krankheiten (ECDC) bietet eine interaktive Karte an, auf der man die Bedingungen für die Vermehrung von Vibrionen in europäischen Küstengewässern nachverfolgen kann.
Typ IV
Typ IV tritt sehr selten auf und wird durch Pilze (häufig Candida albicans) verursacht. Betroffen sind meist stark immunsupprimierte Personen mit traumatischen Wunden oder Verbrennungen.